25 de febrero de 2013–La U.S. Food and Drug Administration amplió el uso aprobado de Stivarga (/Regorafenib) para tratar a pacientes con tumores del estroma gastrointestinal (GIST) avanzados, que no pueden ser resecados quirúrgicamente y que no responden a otros tratamientos aprobados por a FDA para esta enfermedad.
GIST es un tumor es un tumor en el cual células cancerígenas se forman en los tejidos del tracto gastrointestinal, parte del sistema digestivo. De acuerdo al Cáncer National Institute, se estima que en los Estados Unidos anualmente se presentan entre 3,300 y 6,000 nuevos casos, con mayor incidencia en adultos mayores.
Stivarga, un inhibidor de una multi quinasa, bloquea varias encimas que favorecen el crecimiento del cáncer. Con esta nueva aprobación, Stivarga s
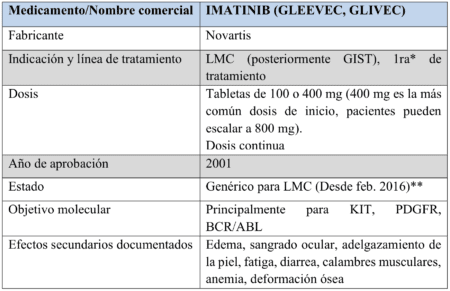
Está destinado para usarse en pacientes cuyo cáncer GIST no puede ser resecado quirúrgicamente, o que se ha diseminado a otras partes del cuerpo (metástasico) y que ya no responde a Glivec (imatinib) y Sutent (sunitinib), los otros dos fármacos aprobados por la FDA para tratar GIST.
“Stivarga es el tercer fármaco aprobado por la FDA para tratar tumores del estroma gastrointestinal”, dijo Richard Pazdur, M.D., director de la Oficina de Productos Hematológicos y Oncológicos (Office of Hematology and Oncology Products), en el Centro para la Evaluación e Investigación (Center for Drug Evaluation and Research) de la FDA. “Provee de una importante opción de tratamiento para pacientes con GIST para quienes los otros fármacos aprobados ya no son efectivos.”
Stivarga fue revisado dentro del programa prioritario de la FDA, que ofrece una revisión expedita de seis meses a fármacos que pueden ofrecer un tratamiento seguro y efectivo cuando no existe un tratamiento alternativo satisfactorio, o que ofrecen una mejora significativa comparada con otros productos en el mercado. Este fármaco también es considerado como un producto huérfano, debido a que está destinado a tratar una enfermedad rara.
La seguridad y eficacia del uso de Stivarga fue evaluado en un ensayo clínico de 199 pacientes con GIST que no podía ser removido quirúrgicamente y habían tenido progresión después del tratamiento con Glivec y Sutent. Los pacientes fueron seleccionaos al azar para recibir Stivarga o placebo. Todos los pacientes recibieron el mejor tratamiento de apoyo, que incluye tratamiento para el manejo de los efectos laterales y los síntomas del cáncer.
Los pacientes en el estudio recibieron Stivarga o placebo hasta que el cáncer progresó, o hasta que los efectos laterales se hicieron intolerables. Los resultados demostraron que los pacientes quienes tomaron Stivarga tuvieron un retraso en el crecimiento tumoral (sobrevivencia libre de progresión), que fue en promedio, 3.9 meses más tarde que los pacientes a quienes se dio placebo. A los pacientes que recibieron placebo se les permitió tomar Stivarga cuando su cáncer progresó.
El efecto lateral más común informado por los pacientes tratados con Stivarga fue debilidad y fatiga, síndrome de manos y pies (también llamado eritrodisestesia palmar y plantar), diarrea, pérdida de apetito, presión alta, heridas en la boca, infección, cambios en el volumen y calidad de la voz, dolor, pérdida de peso, dolor de estómago, sarpullido, fiebre y náusea.
Efectos laterales serios, que ocurrieron en menos del uno por ciento de los pacientes, fueron daño hepático, hemorragia severa, heridas y descamación de la piel, presión muy alta que necesitó tratamiento de emergencia, infartos y perforaciones en los intestinos.
Stivarga fue aprobado en Septiembre 2012 para tratar el cáncer colo-rectal. Es comercializado por Bayer HealthCare Pharmaceuticals, ubicados en Wayne, N.J. Glivec es comercializado por East Hanover, de Novartis ubicado en N. J., y Sutent es comercializado por Pfizer ubicado en la ciudad de Nueva York.
Para más información:
FDA: Office of Hematology and Oncology Products

You must be logged in to post a comment.